手性保留的分子内傅克烷基化反应使得轴手性纯碳氢共轭螺环的合成成为可能。利用这种手性保持的傅克烷基化反应,游劲松/兰静波团队开发了一种迭代合成策略,通过手性叔醇单元的立体专一性转化,像"合上拉链" 一样精准高效地构建了手性多螺碳桥连碳环化合物。
螺环骨架的固有刚性和空间位阻特性使其在手性化学中具有重要价值,能够提供构象稳定性和特殊的手性微环境。然而,通过分子内傅克烷基化型螺环化反应,从手性叔醇构建手性螺环一直被认为不可行,因为平面构型的碳正离子中间体的形成会导致立体化学信息的丢失(图a)。现有的手性螺环合成策略主要依靠不对称催化或外消旋螺环混合物的手性拆分。这些方法通常需要特定官能团(如酚羟基)来实现立体控制,限制了对于缺乏此类官能团的底物的适用性(图b-c)。当目标化合物为含有多个螺碳中心的手性化合物时,挑战进一步加剧,因为手性元素数量的增加会产生一系列难以控制和拆分的复杂手性异构体。
四川大学游劲松教授与兰静波教授团队长期致力于基于C−H活化反应构筑有机光电材料。因此,本研究工作最初的目标是开发一种基于C−H活化策略的迭代合成途径,用于构建纯碳氢共轭螺环,一开始并未考虑立体化学问题。意外的是,在外消旋的(R,S)-C3TS-4OH和(S,R)-C3TS-4OH通过分子内傅克螺环化反应合成多螺碳桥联低聚(反式-二苯乙烯) 4SpiroC3TS时,单晶X射线衍射显示仅生成了(R,S)-构型产物(图e)。从机理上来讲,该反应将通过平面化的碳正离子中间体进行,这将导致快速外消旋化,从而生成四个手性异构体(R,R)-、(S,S)-、(R,S)-和(S,R)-4SpiroC3TS的混合物。(R,S)-和(S,R)-4SpiroC3TS是同一个化合物,是内消旋体。也就是说,反应最终应该得到三个手性异构体。因此,这里观察到的分子内傅克螺环化反应仅生成单一构型的(R,S)-4SpiroC3TS的实验事实很清楚地表明,反应起始物的手性在螺环化过程中得以保留。为了证实这一意外结果,作者设计并进行了两个模型反应,以探究这种立体化学保持的原因。研究结果进一步支持分子内傅克螺环化反应中存在手性记忆,避免了底物立体化学信息的丢失。密度泛函理论计算为分子内傅克烷基化反应中观察到的手性保持提供了更进一步的解释。具体而言,该转化通过手性的两步传递机制进行:叔醇的中心手性先传递至碳正离子中间体的瞬态轴手性,再传递至螺环的轴手性。手性传递或手性记忆的关键在于,分子内傅克烷基化的速率常数(krxn)远高于碳正离子中心单键旋转的速率常数(krot),否则将导致外消旋化。这种动力学偏好使得手性在整个螺环化过程中得以保留,即使在室温下反应也是如此(图d)。
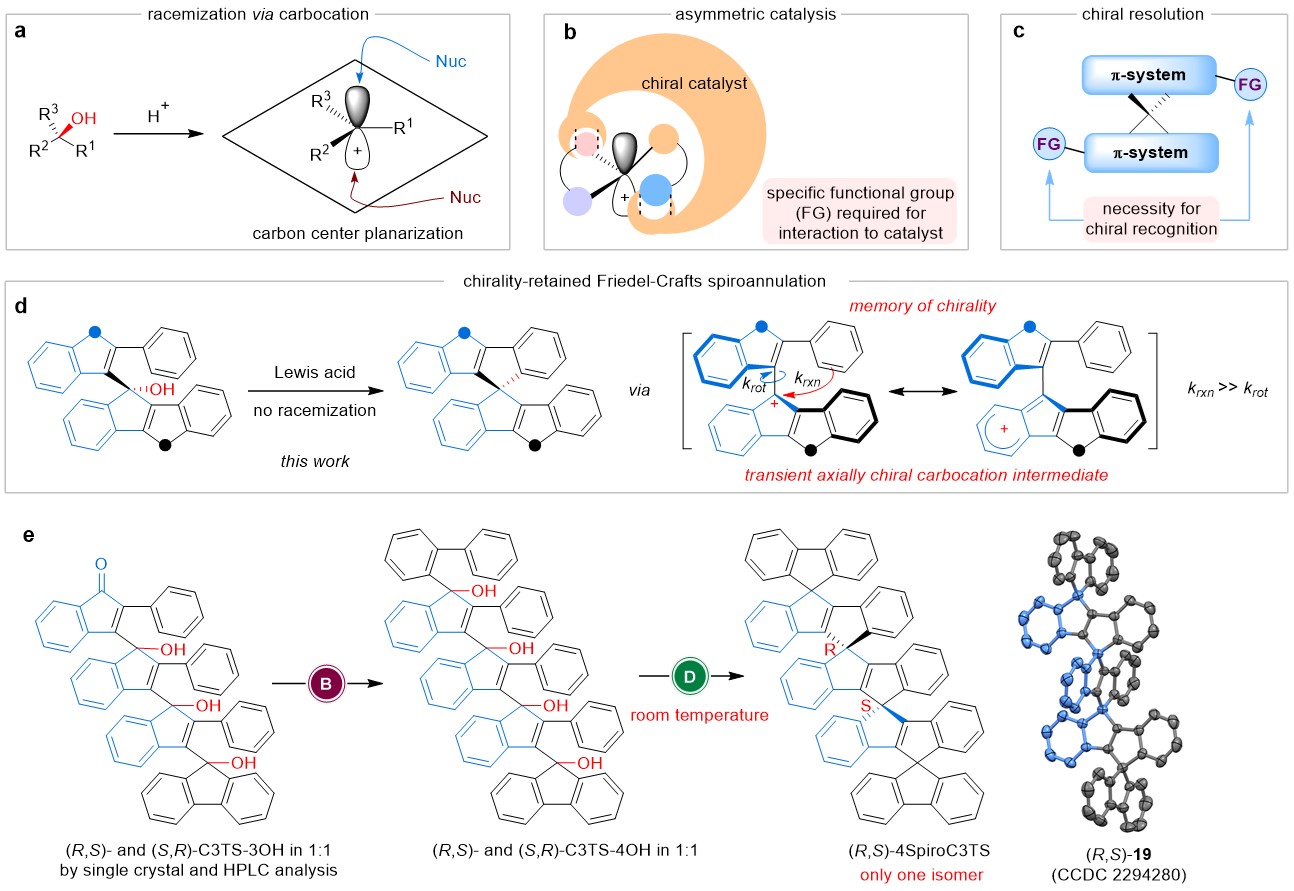
利用手性保持的傅克螺环化反应,作者开发了一种迭代合成策略,用于纯碳氢共轭螺环的立体专一性合成。首先使用铑催化的区域选择性C−H活化/环化反应制备手性叔醇前体。最后,每个手性叔醇单元通过立体专一性转化形成螺环结构,就像完成一个“拉链闭合”的过程。
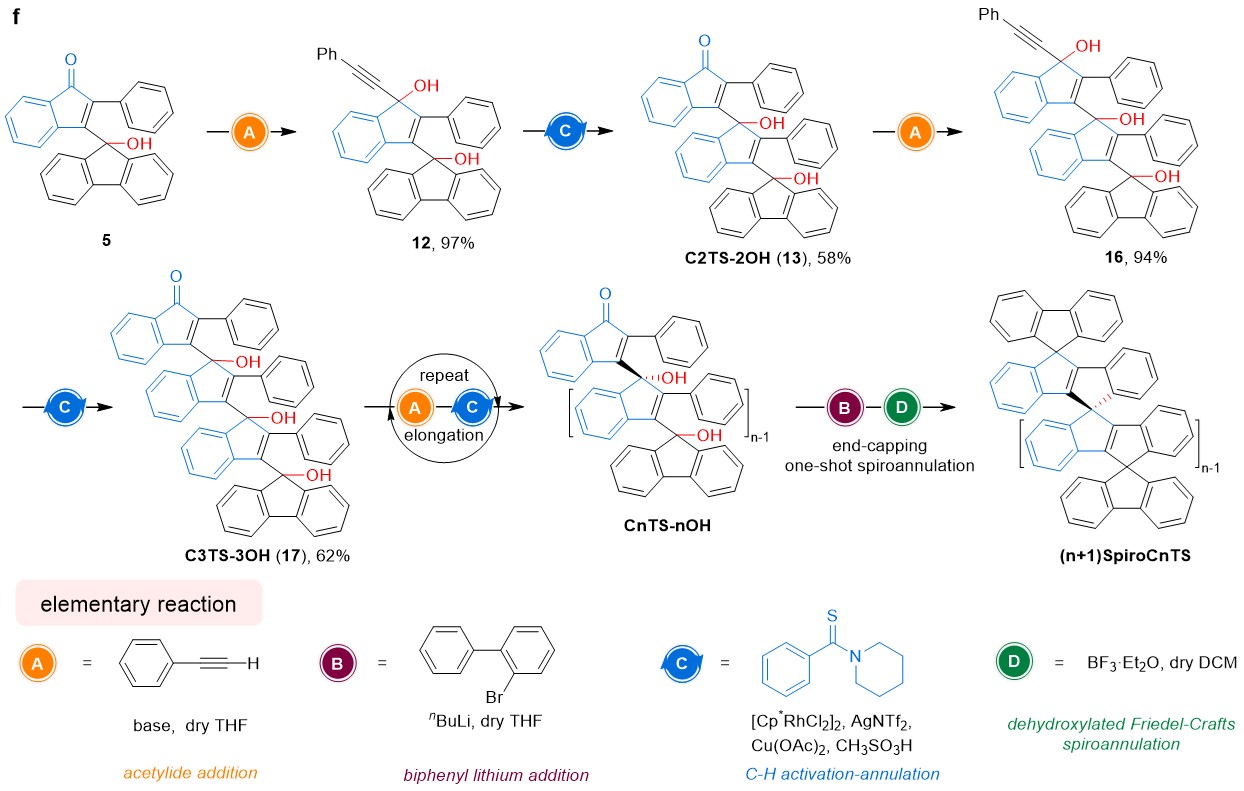
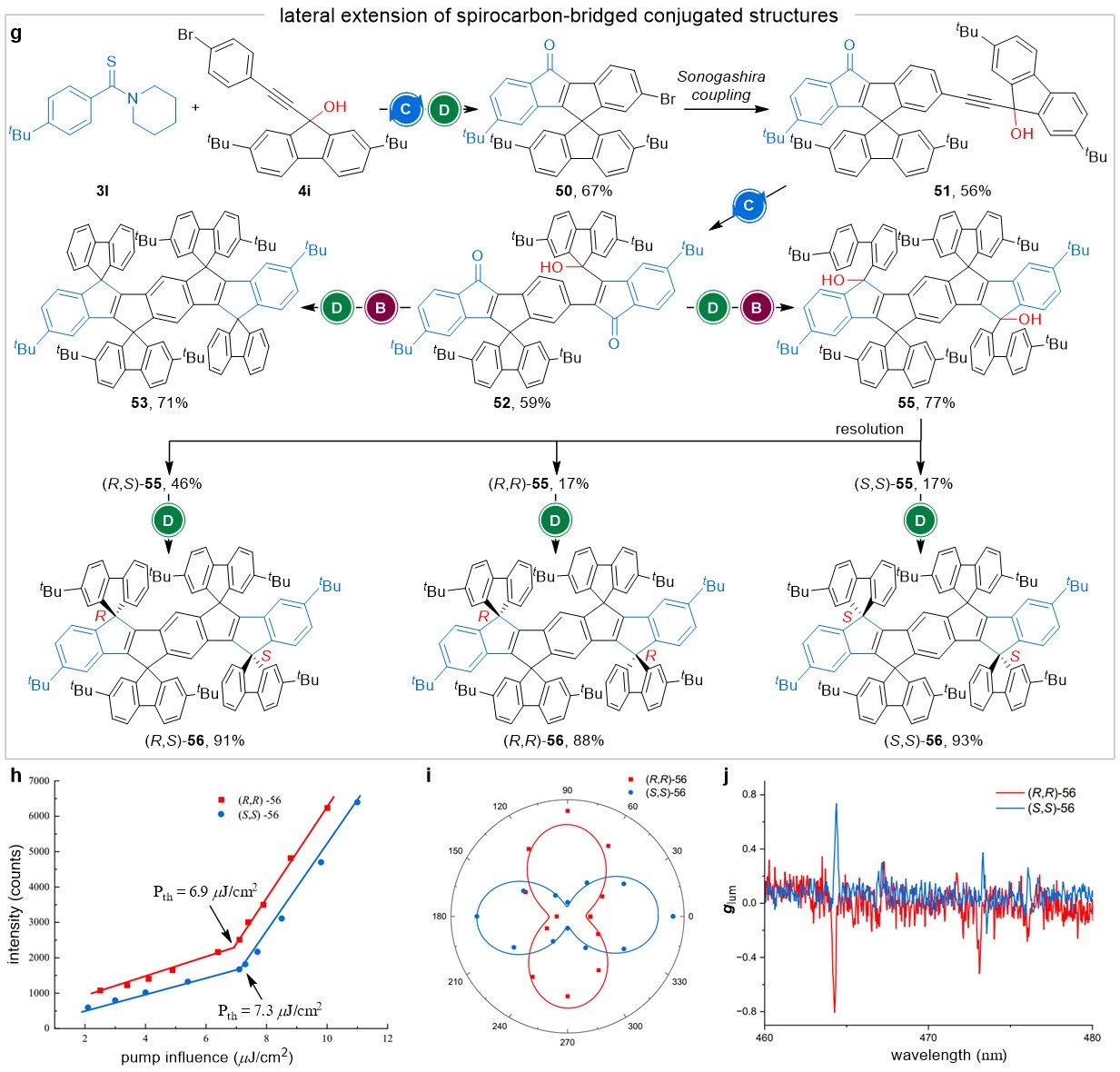
这一合成策略不仅能纵向扩展螺环结构,还能实现螺环的横向延伸。在螺环骨架的纵向扩展中,仅生成(R)-和(S)-构型交替的多螺碳桥联共轭碳环,这由手性叔醇前体在铑催化的区域选择性C−H活化/环化反应中的热力学稳定性决定。因此,偶数个手性螺碳将导致唯一产物——内消旋螺环化合物的生成。这种立体化学结果的固有局限性最终促使作者发现了手性保持的傅克螺环化反应。
最后,作者利用该迭代合成策略进行螺环结构的横向延伸,制备了基于低聚(对亚苯基亚乙烯基)的手性纯碳氢共轭螺环。这些手性螺环化合物表现出优异的光物理性质,使其能够应用于圆偏振激光。
该研究以"Chirality retention in Friedel–Crafts spiroannulation for iterative synthesis of spiro-bridged conjugated carbocycles"为题目发表在Nature synthesis上,四川大学游劲松教授、兰静波教授、中科院化学所赵永生教授以及南方科技大学余沛源助理教授为该论文通讯作者,四川大学蒲兴文博士、中科院化学所周忠豪博士和南方科技大学研究生卢逸为论文的共同第一作者。感谢国家自然科学基金委、四川省科技厅、广东省催化重点实验室、XPLORER奖新基石科学基金、中央高校基本科研业务费专项资金、FB体育官网-FB体育试玩
分析测试平台、南方科技大学化学系计算科学与工程中心以及CHEM高性能超级计算机集群(CHEM-HPC)的支持。感谢四川大学分析测试中心邓鹏翅老师和罗代兵老师在高温核磁以及晶体结构解析中提供的帮助。
文章链接: //doi.org/10.1038/s44160-025-00817-4
